Диагностика вирусной пневмонии
Вирусная пневмония. Диагностические особенности
Исследования показывают, что у пациентов часто развивается инфекция, вызванная одновременно бактериальными и вирусными возбудителями, что не позволяет исключить бактериальные заболевания, даже если результаты экспресс-тестов на вирусы положительны. Кроме того, нет уникальных идентифицирующих клинических характеристик, которые позволяют врачу в отделении неотложной помощи (ОНП) дифференцировать вирусное заболевание от бактериального.
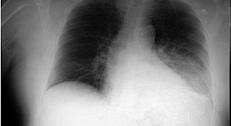
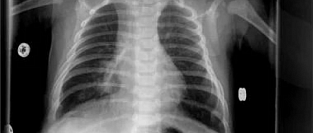
Следовательно, способа точного определения пневмонии во время первоначального визита в отделение неотложной помощи нет. У пациентов с подозрением на пневмонию рекомендуется выполнить рентгенографию грудной клетки, как для выявления осложнений, например, плеврального выпота, так и для предотвращения ненужного использования антибиотиков у здоровых пациентов с бронхитом, а не с пневмонией.
Вирусы гриппа являются наиболее частой причиной вирусной пневмонии у взрослых гражданских лиц. Грипп обычно наблюдается при и . Грипп типа A чаще всего вызывает крупные эпидемии и пандемии; это самая частая причина вирусной пневмонии у взрослых.
Эпидемии гриппа возникают в зимние месяцы и характеризуются значительной с развитием осложнений и . У пациентов с хронической обструктивной болезнью легких (ХОБЛ), сердечной недостаточностью, гемоглобинопатиями и иммуносупрессией повышен риск тяжелого течения заболевания, которое может привести к смерти. Вирус гриппа передается от человека человеку главным образом . Инкубационный период после заражения составляет 1-5 дней.
Грипп следует заподозрить у пациентов с высокой лихорадкой, миалгией и кашлем в зимние месяцы. Если результаты теста на грипп отрицательные, у пациентов с ринитом, свистящим дыханием, субфебрильной температурой и очаговыми инфильтратами на рентгенограммах грудной клетки, в зимние месяцы также обосновано подозрение на РСВ-пневмонию.
Вирусы и факторы организма
Возраст пациента и иммунный статус могут помочь при определении возможной этиологии вирусной пневмонии. Следующие вирусы часто вызывают пневмонию у детей:
- Респираторно-синцитиальный вирус
- Вирусы гриппа A и B
- Вирус парагриппа
- Аденовирус
- Человеческий метапневмовирус
- Коронавирус
- Вирус кори (у непривитых детей)
Следующие вирусы часто вызывают пневмонию у иммунокомпетентных взрослых:
- Вирусы гриппа A и B
- Аденовирус
- Респираторно-синцитиальный вирус
- Вирус парагриппа
- Коронавирус
- Вирус ветряной оспы
Следующие вирусы часто вызывают пневмонию у людей с иммунодефицитом:
- Цитомегаловирус
- Вирус простого герпеса
- Вирус гриппа
- Респираторно-синцитиальный вирус
- Вирус парагриппа
- Аденовирус
- Вирус ветряной оспы
Дифференциальные диагнозы
- Аденовирус
- Аспирационный пневмонит и пневмония
- Бактериальная пневмония
- Внебольничная пневмония (ВБП)
- Цитомегаловирус (ЦМВ)
- Энтеровирусы
- Грибковая пневмония
- Хантавирусный легочный синдром
- Трансплантация сердца
- Трансплантация сердца и легких
- Простой герпес
- Опоясывающий герпес
- Грипп
- Трансплантация печени
- Трансплантация легких
- Вирусы парагриппа человека и другие вирусы парагриппа
- Плевральный выпот
- Пневмококковые инфекции (Streptococcus pneumoniae)
- Пневмония, вызванная Pneumocystis jiroveci (PJP)
- Дыхательная недостаточность
- Вирус ветряной оспы (ВВО)
Обследование пациента
Общий подход
За последнее десятилетие совершенствование диагностических методов привело к значительному улучшению возможности обнаруживать вирусы в . Однако выявление вирусных возбудителей не всегда указывает на активное заболевание. Например, герпесвирусы могут реактивироваться, не вызывая значимого активного заболевания. Точно так же респираторно-синцитиальный вирус (РСВ) и цитомегаловирус (ЦМВ) могут быть обнаруживаться вместе с другими известными бактериальными возбудителями.
В большинстве случаев основой точной этиологической диагностики являются вирусологические анализы. Экспресс-тесты для определения антигена могут дать результаты в течение нескольких часов, поэтому они полезны в отделении неотложной помощи. Чувствительность и специфичность этих тестов составляет от 80% до 95%. См. таблицу 1.
Таблица 1. Методы диагностики вирусной пневмонии
|
Вирус |
Вирусологический метод |
Цитологическое исследование |
Экспресс-тест для определения антигена |
Амплификация генов |
|
Вирус гриппа |
ГАa, ОККb |
|
ИФc, ИФАd |
ОТ-ПЦРe |
|
Аденовирус |
ЦПЭf, ОКК |
Внутриядерные включения |
ИФ, ИФА |
ОТ-ПЦР |
|
| ||||
|
Парамиксовирусы |
|
| ||
|
Респираторно-синцитиальный вирус |
ЦПЭ, ОКК |
Эозинофильные цитоплазматические включения |
ИФ, ИФА |
ОТ-ПЦР |
|
Вирус парагриппа |
ГА, ОКК |
Эозинофильные внутриядерные включения |
ИФ, ИФА |
ОТ-ПЦР |
|
Вирус кори |
ГА |
|
|
|
|
Герпесвирусы |
|
| ||
|
Вирус простого герпеса |
ЦПЭ, ОКК |
Цитоплазматические включения |
ИФ, ИФА |
ПЦР |
|
Вирус ветряной оспы |
ЦПЭ |
Цитоплазматические включения |
ИФ |
ОТ-ПЦР |
|
Цитомегаловирус |
ЦПЭ, ОКК |
Клетки «совиный глаз» |
ИФ, ИФА |
ОТ-ПЦР |
|
Хантавирус |
|
|
Антитела к FCVg |
РНК FCV с помощью ОТ-ПЦР |
|
a ГА - Гемагглютинация b ОКК - Однослойная культура клеток во флаконах c ИФ - Иммунофлюоресценция d ИФА – Иммуноферментный анализ eОТ-ПЦР - Полимеразная цепная реакция с обратной транскрипцией fЦПЭ - Цитопатогенные эффекты gFCV – Вирус «четыре угла» | ||||
Вирусологическое исследование остается критерием стандарта для большинства вирусных возбудителей, но оно требует много времени. Поэтому были разработаны более быстрые методы, например, выявление вирусного антигена, но их результаты, как правило, менее , чем у традиционного метода с использованием клеточных культур.
Амплификация нуклеинового материала вируса, например, , различные полимеразные цепные реакции (ПЦР), [66] и серологические анализы, может использоваться для отслеживания нарастания специфических сывороточных антител и для диагностических целей.
В последнее время интерес был сосредоточен на разработке тестов на основе ПЦР с единичным, мультиплексным считыванием данных и считыванием данных в реальном времени. У этих тестов чувствительность лучше, чем у культуральных методов.
Самыми чувствительными методами являются "вложенная" ПЦР и ПЦР с (ОТ). Они увеличили частоту обнаружения респираторных вирусов у взрослых с гемобластозами и пневмонией с 19% до 35%.
ПЦР ограничена тем, что результаты не могут полностью исключить образцов. У некоторых пациентов с иммунодефицитами, которые выделяют вирус в течение длительных периодов времени, диагноз может иметь небольшое клиническое значение. Это ограничение преодолевается с помощью количественной ПЦР, которая показывает уровень вирусной нагрузки. Результаты также могут помочь дифференцировать активную инфекцию от контаминации.
Поскольку различных возбудителей пневмонии, как вирусных, так и бактериальных, сложно различить, обследование пациентов с симптомами и инфильтратами на рентгенограмме должно включать лабораторные исследования.
Цитологическое исследование
Секреты дыхательных путей, образцы бронхоальвеолярного лаважа и образцы тканей можно исследовать с помощью цитологических и гистологических методов. В клетках, инфицированных ДНК-содержащими вирусами, часто обнаруживаются внутриядерные включения, а в клетках, инфицированных РНК-содержащими вирусами - цитоплазматические включения.
Для ЦМВ-инфекции характерно появление клеток типа "совиный глаз", которые представляют собой крупные клетки с базофильными внутриядерными включениями и прозрачной зоной вокруг.
Наличие вирусных включений является диагностическим признаком, хотя этот метод обладает низкой чувствительностью. Следовательно, отсутствие включений не всегда позволяет исключить инфекцию или активное заболевание.
Вирусологическое исследование
Вирусную пневмонию можно диагностировать с помощью выделения и идентификации возбудителя при вирусологическом исследовании.
Для вирусологического исследования могут использоваться ткани из верхних или нижних дыхательных путей, образцы и образцы, полученные при промывании носоглотки, бронхоальвеолярном лаваже и . Необходима соответствующая вирусная транспортная среда. Она состоит из обогащенного бульона, содержащего антибиотики и белковый субстрат.
Вирусологические исследования проводятся на различных клеточных линиях (например, клетки почек обезьян, диплоидные фибробласты). Культуры клеток инкубируют при температуре 35°С и исследуют под микроскопом каждые два дня в течение периода инкубации продолжительностью 14 дней.
Культуры исследуют для обнаружения цитопатогенных эффектов и вирусного роста. Цитопатогенный эффект заключается в формировании синцитиальных скоплений многоядерных гигантских клеток и редко является вирусоспецифичным. Рост вируса обнаруживают с помощью , при котором происходит эритроцитов к монослою культуры клеток инфицированной ткани.
Дальнейшая идентификация вирусов осуществляется с использованием иммунофлюоресцентного (прямого или косвенного) метода или зондов на основе нуклеиновых кислот. Эти методы применяют для идентификации определенного вируса в клеточных культурах.
Вирусологические исследования менее эффективны при РСВ-инфекции (вирусная лабильность, более низкие титры в образцах), человеческом метапневмовирусе (hMPV) и коронавирусной инфекции (особые потребности в питательных веществах для роста).
Модифицированные методы культивирования клеток, называемые однослойными культурами клеток во флаконах, способны обнаруживать некоторые медленно растущие вирусы. Эти системы культивирования широко используются для раннего выявления ЦМВ, РСВ, вируса простого герпеса (ВПГ), аденовируса, вируса гриппа, вируса парагриппа (вирус ПГ) и других вирусных возбудителей.
По этой методике подготовленные клинические образцы инокулируют на адгезированные клеточные монослои, выращенные на круглых покровных стеклах в маленьких флаконах. Флаконы центрифугируют при низкой скорости в течение одного часа, после чего добавляют свежую питательную среду. Затем флаконы инкубируют и последовательно исследуют для выявления экспрессии вирусного антигена или ДНК. Результаты обычно можно получить через 2-3 недели.
Окрашивание мокроты по Граму
Образцы мокроты для окрашивания по Граму часто контаминированы патогенными микроорганизмами из полости рта, и такие образцы трудно получить. Этот метод не рекомендуется Американским обществом специалистов в области торакальной медицины (American Thoracic Society) или Американской коллегией врачей неотложной помощи (American College of Emergency Physicians), хотя Американское общество специалистов по инфекционным болезням (Infectious Diseases Society of America) рекомендует получить образец мокроты, особенно у госпитализированных пациентов.
Микробиологическое исследование крови
Целесообразность микробиологического исследования крови у пациентов с пневмонией остается спорной. Следует ознакомиться с местными больничными протоколами, чтобы определить, какие пациенты с пневмонией являются кандидатами для госпитализации, и у кого следует взять образцы крови для микробиологического исследования до назначения лекарственных препаратов.
Экспресс-тесты для определения антигена
Экспресс-тесты для определения антигены дают результаты быстрее, потому что тест проводится непосредственно с образцами, полученными у пациента, а мазки или смывы из полости носа легко взять.
Для диагностики ВПГ, РСВ, вирусов гриппа А и В, вируса ПГ, ЦМВ и других респираторных вирусов разработаны иммунофлюоресцентный анализ и твердофазный иммуноферментный анализ (ИФА). ИФА позволяет обнаруживать вирусные антигены, в то время как иммунофлюоресцентный анализ требует наличия подготовленных, интактных, инфицированных клеток. этих методов зависят от исследуемого вируса и конкретного метода диагностики.
Преимущества тестов для определения антигена заключаются в более высокой для отдельных вирусов. Кроме того, эти анализы остаются положительными в течение нескольких дней или недель, еще долго после того, как методика культивирования может обнаружить жизнеспособный вирус.
Недостатки этих методов заключаются в том, что общая ниже, чем у вирусологических исследований. Следовательно, для оптимальной диагностики вирусных инфекций методы определения антигена должны использоваться в сочетании с клеточной культурой. [67]
Экспресс-тесты для определения антигенов РСВ полезны у детей младшего возраста, которые выделяют высокие титры вируса, но чувствительность этого метода у взрослых низкая (0-20%) по сравнению с ОТ-ПЦР.
Чувствительность экспресс-тестов для сезонного гриппа у взрослых составляет от 50% до 60%, а специфичность превышает 90%. Новый вирус свиного гриппа А H1N1 также должен обнаруживаться с помощью экспресс-тестов на грипп. Однако чувствительность экспресс-тестов значительно ниже (51-63%) по сравнению с ОТ-ПЦР. К сожалению, экспресс-тесты на грипп имеют очень низкую чувствительность и специфичность к вирусу птичьего гриппа H5N1 и поэтому не рекомендуются у таких пациентов.
Когда пациенты с подозрением на вирусную инфекцию обращаются в отделение неотложной помощи, лучше всего позвонить в лабораторию больницы, чтобы определить оптимальный тест, который необходимо заказать, а также следует ли запрашивать идентификацию определенного вируса или же общий запрос подразумевает исследование на группу возбудителей. Если результаты экспресс-теста отрицательные, но клиническая вероятность вирусной инфекции велика, можно взять образцы для культурального метода и лечить пациента до получения результатов. Положительная идентификация вируса не позволяет исключить бактериальную коинфекцию.
Амплификация генов
ПЦР является высокочувствительным и специфическим методом амплификации генов для обнаружения вируса. Для многих вирусов это оптимальный диагностический тест, и, если возможно, его следует использовать в сочетании с вирусологическим исследованием, а также с иммуноцитологическими и экспресс-тестами для определения антигены. Методика ПЦР позволила обнаруживать такие вирусы, как РСВ, hMPV и коронавирусы, вызывающие пневмонию.
Для вирусов гриппа H1N1 и птичьего гриппа ОТ-ПЦР с использованием мазков из носоглотки или бронхиального аспирата/ мокроты является лучшим диагностическим методом.
ПЦР стала особенно полезной для выявления ЦМВ в различных жидкостях организма (например, в крови, моче) у пациентов с тяжелыми иммунодефицитами, особенно у реципиентов гемопоэтических стволовых клеток (ТГСК).
Недавно разработанная методика молекулярной диагностики, мультиплексная полимеразная цепная реакция с обратной транскрипцией (ОТ-МПЦР), позволяет быстро обнаруживать вирусы гриппа типов A и B, РСВ (типы A и B), аденовирусы, вирус ПГ (типы 1, 2 и 3), hMPV и риновирус в соответствующих секретах дыхательных путей. [68, 69] Одношаговая методика ОТ-МПЦР обладает высокой чувствительностью и специфичностью. Грипп H1N1 является "не типируемым гриппом" с помощью ОТ-МПЦР.
Серологические исследования
Поскольку, по определению, для описанных серологических исследований необходимо взятие крови в фазе реконвалесценции, они не так полезны при неотложном лечении пациента, если еще не прошло достаточно времени, чтобы взятый сразу же образец крови мог представлять собой титр реконвалесцента. В этой ситуации один высокий титр позволяет поставить диагноз.
Серологические исследования особенно полезны для окончательного подтверждения диагноза, особенно для подтверждения положительных результатов других диагностических тестов.
Газы артериальной крови
Газы артериальной крови могут иметь большое значение для выявления гипоксемии при тяжелом заболевании, но при легком или умеренном течении заболевания они не нужны. Пульсоксиметрия необходима у всех пациентов.
Вирус-специфические лабораторные исследования
Разработаны вирус-специфические лабораторные исследования для таких вирусов, как вирус гриппа, респираторно-синцитиальный вирус, аденовирусы, вирус парагриппа, человеческий метапневмовирус, вирус ветряной оспы, вирус кори, цитомегаловирус, вирус простого герпеса и хантавирус. У пациентов с серьезным заболеванием, вызванным вирусом H1N1 2009, следует проверять и контролировать функцию почек, поскольку у таких пациентов часто наблюдается острое повреждение почек [70, 71].
Вирус гриппа
Вирус гриппа можно выделить из мазков из носа/ горла, смывов из полости носа и мокроты при вирусологическом исследовании (в различных клеточных линиях почек). Вероятность выделения вируса ниже всего при исследовании мазков из горла. Девяносто процентов положительных результатов могут быть обнаружены в течение трех дней после инокуляции, а остальные положительные результаты - к седьмому дню.
Разработано множество экспресс-тестов на вирус гриппа типов A и B, но их чувствительность составляет 40-80% по сравнению с вирусологическим исследованием. Однако специфичность экспресс-тестов высокая (85-100%). Как указано выше, новый вирус свиного гриппа также можно обнаружить с помощью экспресс-тестов, но их чувствительность в этом случае низкая (51-63%), а для птичьего гриппа этот тест бесполезен. Для этих двух штаммов гриппа самым полезным диагностическим тестом является ОТ-ПЦР мокроты.
Респираторно-синцитиальный вирус
РСВ можно выделить культуральным методом (клеточные линии HEp-2, HeLa, A549), причем смывы из носоглотки или секреты трахеи более эффективны, чем мазки из носа. У пациентов с иммунодефицитом положительны 15% смывов из носоглотки по сравнению с 71% образцов эндотрахеальных секретов и 89% образцов бронхоальвеолярного лаважа.
Экспресс-диагностика с помощью ИФА имеет чувствительность 50-90% (выше у детей, но ниже у взрослых), но высокую специфичность (90-95%). Также разработана ОТ-ПЦР, особенно в комбинации с праймерами других вирусов (ОТ-МПЦР).
Аденовирусы
Аденовирусы можно выделить из секретов дыхательных путей и культивировать в клетках эмбриональных почек человека, клетках опухоли гортани человека (HEp-2) и клетках HeLa. Цитопатические эффекты проявляются через 2-20 дней и включают эозинофильные и диффузные базофильные внутриядерные включения.
Серотип 14 можно диагностировать с помощью вирусологического исследования, экспресс-теста с прямой реакцией имуннофлюоресценции для определения антител и ПЦР. Было показано, что в популяции реципиентов ТГСК выделение аденовируса из плазмы с помощью ПЦР является убедительным предиктором заболевания, особенно при пороговом значении 1000 копий/мл. [72]
При подозрении на аденовирус 14 серотипа на основании тяжести заболевания и отрицательных бактериальных и вирусологических исследований, клиницисты должны обратиться в государственный департамент здравоохранения для получения помощи в обследовании пациента. [73]
Вирус парагриппа
Вирус парагриппа можно выделить в культуре клеток (различных клеточных линиях почек), предпочтительно из секрета носовой полости. Выделение этого вируса является убедительным доказательством инфекции. ПЦР более чувствительно и позволяет быстрее обнаружить вирус, а также выпускается в едином мультиплексном наборе для анализа.
Человеческий метапневмовирус
Человеческий метапневмовирус сложно выделить в стандартных клеточных культурах, и он очень медленно размножается (растет). Оптимальной клеточной линией является третичная культура клеток почек яванских макаков или макаки-резуса с добавлением трипсина; для обнаружения цитопатического эффекта культуры инкубируют в течение 21 дня. Из-за сложностей культурального метода предпочтительным методом диагностики является ОТ-ПЦР.
Вирус ветряной оспы
Инфекцию и пневмонию, вызванные вирусом ветряной оспы (ВВО), диагностируют в основном по клиническим признакам. ВВО можно выделить из везикулярной жидкости, секретов дыхательных путей или спинномозговой жидкости (СМЖ) с помощью культурального метода. Для экспресс-тестов с определением антигена, например, метода прямой иммунофлюоресценции, используют соскобы с кожных высыпаний.
В мазке для пробы Цанка, полученном из свежей, невскрывшейся везикулы, могут быть обнаружены многоядерные гигантские клетки с эозинофильными внутриядерными включениями, но этот метод не позволяет различить ВПГ и ВВО и имеет чувствительность 60%. Также применяют ПЦР для ВВО с использованием различных жидкостей организма (в частности, СМЖ).
Вирус кори
Коревую пневмонию обычно диагностируют клинически, но может быть полезна и лабораторная диагностика. Вирус кори культивируют в клеточных линиях почек обезьяны и человека. Цитопатические эффекты наблюдаются через 6-10 дней. Обнаруживаются эозинофильные включения в цитоплазме и ядре инфицированных клеток. Также применяют иммунофлюоресцентное исследование клеток экссудата из носовой полости и парные серологические исследования в остром периоде/ периоде реконвалесценции.
Цитомегаловирус
Цитомегаловирусную пневмонию диагностируют на основании клинической картины у пациента из группы риска (с тяжелыми иммунодефицитами) и гистопатологических данных (базофильные внутриядерные включения по типу "совиного глаза") в биоптате легкого. ПЦР крови для ЦМВ и/или положительная на ЦМВ гемокультура дополнительно подтверждают диагноз. Однако положительные результаты посева на ЦМВ и/или ПЦР следует интерпретировать с учетом других признаков заболевания, поскольку возможно бессимптомное выделение в слюне, мокроте, крови, моче и других жидкостях организма.
Документальное подтверждение виремии с использованием методики однослойной культуры клеток во флаконах коррелирует с положительными на ЦМВ гемокультурами и обычно указывает на ЦМВ-инфекцию с указанными выше оговорками. Наличие антигенемии pp65 также коррелирует с развитием ЦМВ-инфекцию в популяции реципиентов ТГСК.
Вирус простого герпеса
ВПГ-пневмония может быть подтверждена у пациента из группы риска (т.е. у пациента с тяжелым иммунодефицитом) с помощью вирусологического исследования образцов из нижних дыхательных путей (предпочтительно, полученных с помощью бронхоскопии) и гистологического исследования легочной ткани, при котором обнаруживаются многоядерные гигантские клетки. Методы определения антигенов и ПЦР мокроты чрезмерно чувствительны (возможны ложноположительные результаты), а серологические исследования при этом типе пневмонии бесполезны.
Хантавирус
Хантавирусную инфекцию диагностируют на основании обнаружения в сыворотке хантавирус-специфических антител и, в основном в Соединенных Штатах Америки - на выявлении специфических антител к вирусу Син Номбре (SNV). Реже в более исследовательски-ориентированных условиях для обнаружения РНК хантавируса в мононуклеарных клетках периферической крови, легочной ткани и/или эритроцитах может использоваться полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР). Результаты серологической диагностики острой хантавирусной инфекции подтверждают с помощью обнаружения генетического материала в препаратах мононуклеарных клеток периферической крови при ОТ-ПЦР.
Ближневосточный респираторный коронавирусный синдром
- Тестирование на MERS-CoV можно проводить одновременно с тестированием на другие возбудители респираторных инфекций
- Подтверждение наличия другого возбудителя респираторных инфекций не исключает необходимости тестирования на MERS-CoV у пациентов с лихорадкой и пневмонией или острым респираторным дистресс-синдромом (ОРДС), которые развились в течение 14 дней после отъезда с Аравийского полуострова или близлежащих районов или после тесного контакта с человеком лихорадкой и ОРДС, который недавно был в этом регионе
- Если ОРДС обнаружен у группы пациентов, следует выполнить тесты на частые возбудители респираторных инфекций, и такие случаи подлежат регистрации в местных и государственных департаментах общественного здравоохранения. Если медицинские работники находятся в очаге заболевания, и причина ОРДС остается необъясненной, следует рассмотреть целесообразность обследования пациентов на MERS-CoV, даже если контакты в поездках были исключены.
- Лабораторное подтверждение MERS-CoV требует положительного результата ПЦР для 2 или более определенных геномных мишеней или 1 положительной мишени с секвенированием второй; даже если обнаружен другой возбудитель, кроме MERS-CoV, пациент, чье заболевание соответствует этим требованиям, все равно может быть классифицирован как вероятный случай MERS-CoV.
- Путешественникам в Саудовскую Аравию следует избегать контактов с больными людьми, часто мыть руки и обращаться за медицинской помощью при появлении лихорадки с кашлем или одышки во время поездки или в течение 14 дней после возвращения домой.
- Для госпитализированных пациентов с подтвержденной или подозреваемой инфекцией MERS-CoV рекомендуются стандартные меры предосторожности для защиты от воздушно-капельных и контактных инфекций
- Государственные меры предусматривают изоляцию и карантин для пациентов с подтвержденной или вероятной инфекцией MERS-CoV до тех пор, пока они не перестанут быть контагиозными.
Биопсия легкого
В редких случаях ля постановки диагноза у пациентов в очень тяжелом состоянии, которые часто имеют иммунодефицит, необходима биопсия легкого (т. е. трансбронхиальная с помощью бронхоскопа, трансторакальная с помощью торакоскопа или открытая биопсия.
Бронхоальвеолярный лаваж
Бронхоальвеолярный лаваж может потребоваться для получения материала для цитологического анализа и микробиологических исследований.
Гистологические изменения
В целом, когда вирусы вызывают пневмонию, они сначала поражают паренхиму, прилегающую к терминальным и дыхательным бронхиолам, а затем заболевание прогрессирует с захватом всей дольки. При быстро прогрессирующей пневмонии наблюдается диффузное альвеолярное повреждение, состоящее из внутриальвеолярного кровоизлияния, интерстициальной лимфоцитарной инфильтрации, отека, отложения фибрина, гиперплазии пневмоцитов 2 типа и образования гиалиновых мембран [77].
Гриппозная пневмония и пневмония, вызванная вирусом птичьего гриппа
Гистологическое исследование легочной ткани при гриппе выявляет отек, очаговые кровоизлияния и клеточную инфильтрацию. В альвеолах может отсутствовать эпителий, и часто обнаруживается внутриальвеолярное кровоизлияние. Для гриппозной пневмонии характерно наличие бесклеточной гиалиновой мембраны, выстилающей альвеолы.
Птичий грипп (H5N1) обычно характеризуется фульминантным, некротическим, диффузным альвеолярным повреждением с очаговым, интерстициальным, малоклеточным фиброзом. (Пневмония, вызванная вирусом H1N1, характеризуется диффузным альвеолярным повреждением, толстыми гиалиновыми мембранами и выраженной пролиферацией фибробластов).
Пневмония, вызванная вирусом ветряной оспы, вирусом кори, и цитомегаловирусная пневмония
При пневмонии, вызванной вирусом ветряной оспы, обнаруживается очаговый некроз, уплотнение легочной ткани, мононуклеарный инфильтрат и внутриядерные включения.
Коревая пневмония кори была названа гигантоклеточной пневмонией Гехта (Hecht), потому что при гистологическом исследовании обнаруживается преимущественно интерстициальный инфильтрат с мононуклеарными клетками и многоядерными гигантскими клетками.
Гистологическое исследование при цитомегаловирусной пневмонии выявляет типичные цитомегалические клетки с внутриядерными и цитоплазматическими включениями. При гистологическом исследовании ткани легких видны мононуклеарные интерстициальные инфильтраты, утолщение альвеолярных стенок, фибринозные экссудаты и кровоизлияния. В легких случаях может быть трудно обнаружить клетки, содержащие тельца включения.
Пневмония, вызванная ВПГ и хантавирусом
Пневмония, вызванная ВПГ, характеризуется паренхиматозным некрозом, кровоизлияниями и мононуклеарными инфильтратами. При бронхоскопии обнаруживается трахеит, бронхит и типичные точечные очаги поражения слизистой оболочки. При гистологическом исследовании в случае ВПГ-инфекции видны многоядерные гигантские клетки и внутриядерные включения.
При гистологическом исследовании в случае пневмонии, вызванной хантавирусом, видны интерстициальные инфильтраты из Т-лимфоцитов и альвеолярный отек легких без выраженного некроза или привлечения полиморфноядерных лейкоцитов. Эти изменения соответствуют тому, что патогенез в основном обусловлен увеличением проницаемости сосудов за счет иммунопатологического механизма. [78]
- Вирусная пневмония. Обзор практических вопросов
- Возбудители вирусной пневмонии
- Эпидемиология вирусной пневмонии
- Патофизиология и патогенез вирусной пневмонии
- Вирусная пневмония. Симптомы и особенности клинической картины
- Диагностика вирусной пневмонии
- Вирусная пневмония. Рентгенография
- Лечение и профилактика вирусной пневмонии
- Вирусная пневмония. Лекарственные средства
- Вирусная пневмония. Осложнения и прогноз